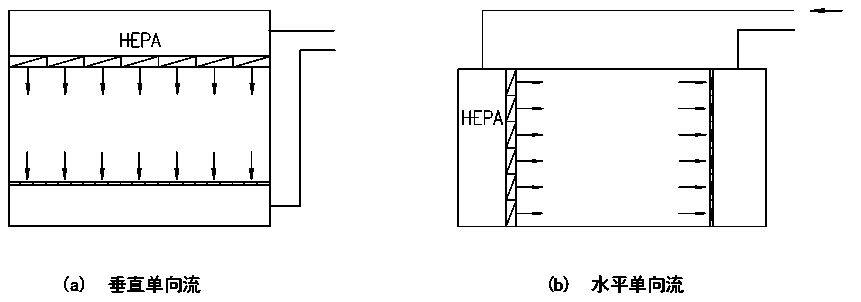
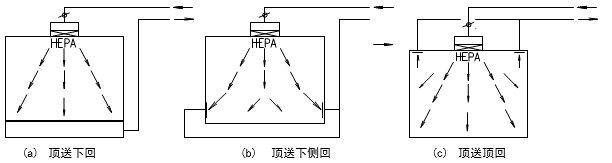
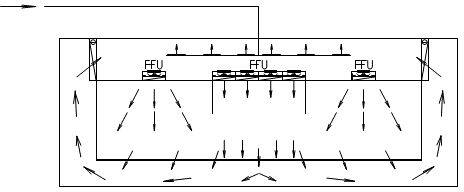
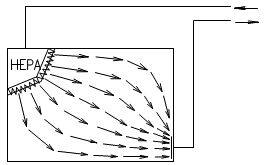
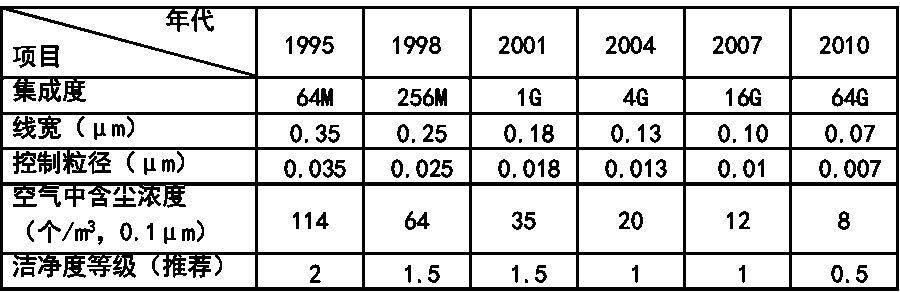
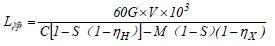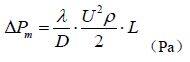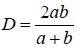根据“洁净厂房设计规范”GB50073-2013中名词解释,洁净室就是“空气悬浮粒子(灰尘、微生物…)浓度受控的房间。其建造和使用方式使房间内进入的、产生的、滞留的粒子最少,同时,还要按生产工艺的要求对房间内的温度、湿度、压力、静电、振动、噪声等其他相关参数也要受控。”洁净室广泛地应用在电子(微电子、光电子等)、航天、机械、化工、农业、制药、医疗、食品、实验动物饲养、生物安全和生物工程等各行各业。从洁净室的建造、使用和维护而言,洁净室有四大技术要素:A、洁净室的净化空调系统至少应有粗效、中效和高效过滤器三级过滤措施。尤其是在终端应有高效过滤器(HEPA)或超高效过滤器(ULPA)。 B、洁净室送风应有足够的空调(消除室内余热、余湿)和净化(保持洁净度)送风量。其送风量不仅能消除室内的余热和余湿,保证室内的温度和相对湿度,同时还能消除或稀释室内的粒子污染,保证室内的洁净度要求。C、洁净室必须建立和维持必要的相对压差(正压或负压)。 D、洁净室应有合理的气流流型,以保证其室内的洁净度和温、湿度等参数。洁净室的分类一般按气流流型来分,还可按使用用途和主要控制对象来分。 洁净室按气流流型来分类可分为单向流洁净室、非单向流洁净室、混合流洁净室和矢流洁净室。单向流洁净室的净化原理是活塞挤压原理,是洁净气流将室内产生的粒子由一端向另一端以活塞型式挤压出去,用洁净气流充满洁净室。单向流洁净室又可分为垂直单向流洁净室和水平单向流洁净室。① 垂直单向流洁净室是在其吊顶上满布(≥80%)高效空气过滤器(或 FFU),经其过滤的洁净气流从吊顶用活塞型式以一定的速度,把室内的污染粒子向地面挤压,被挤压的污染空气通过地板格栅排出洁净室,这样不断地进行循环运行来实现洁净室的高洁净度。垂直单向流洁净室可创造最高的洁净度(1 级~5 级)但是,它的初投资最高、运行费最高。② 水平单向流洁净室是在其一面墙上满布(≥80%)高效空气过滤器,被其过滤的洁净空气以一定的速度用活塞型式将污染粒子挤压到对面的回风墙,由回风墙排出洁净室,这样不断循环来实现高的洁净度等级。水平单向流可创造5级的洁净度等级。其初投资与运行费用也低于垂直单向流洁净室。水平单向流洁净室与垂直单向流洁净室比较,其最大的区别是垂直单向流气流是由吊顶天花流向地面,所有工作面全部被洁净的气流覆盖。而水平单向流洁净室的气流是由送风墙流向回风墙,因此,气流在第一工作面洁净度最高,后面的工作面的洁净度会越来越差。非单向流洁净室的净化原理是稀释原理。是用一定量的洁净空气来充淡稀释室内产生的污染粒子。洁净空气量越多稀释后的洁净度就越高。因此洁净的送风量(换气次数)不同,室内空气的洁净度等级也不相同。在“规范”中规定:6级洁净室的换气次数为 50~60 次/时;7 级洁净室的换气次数为15~25 次/时;8 级和9级洁净室的换气次数为10~15次/时。洁净度级别不同其初投资和运行费也不相同。最常用的非单向流洁净室的气流流型主要有顶送下回、顶送下侧回和顶送顶回。混合流洁净室是将垂直单向流和非单向流两种型式的气流组合在一个洁净室中。混合流洁净室可大大压缩垂直单向流的面积,只将其应用在必要的关键工序和关键部位中,用大面积的非单向流来替代垂直单向流。这样不仅大大地节省建造投资而且也大大地节省了运行费用。这种混合流洁净室目前广泛地应用在微电子(超大规模集成电路)的光电子(液晶显示器LCD、等离子 PDP、发光二极管LED和薄膜晶体管有源矩阵液晶显示器TFT-LCD)等大面积高洁净度等级的电子工业洁净厂房中。矢流洁净室是用圆弧形高效空气过滤器构成的圆弧形送风装置,经圆弧形高效过滤器送出的气流是放射形的洁净气流,流线不产生交叉,灰尘粒子也是被放射形气流带到回风口,回风口设在对面墙的下侧。矢流洁净室可用较少量的洁净送风来实现较高洁净度级别(5级)的洁净室。这种气流流型在美国和日本较多(在日本称为对角流),而我国在工程中应用较少。按使用用途和主要控制对象洁净室又可分为工业洁净室、生物洁净室和生物安全实验室。 工业洁净室的主要控制对象是灰尘粒子。它广泛应用于电子工业、光电子工业、机械化工工业、光学工业、航天事业等。在电子工业中微电子(集成电路)工业对洁净室的洁净度级别要求最高。而且,随着微电子技术的不断发展,集成度的不断提高,光刻线宽的不断变小对洁净室洁净度等级的要求也越来越高。根据国际半导体工业协会(SIA)对未来集成电路发展趋势,以及对洁净生产环境中尘粒控制的趋势预测可以看到微电子工业对洁净室洁净度的要求。SIA 对集成电路发展和对洁净生产环境控制趋势的预测
| | | | |
| | | | |
| | | | |
| | | | 工作区、多层掩膜加工区、高密度磁盘制造区、半导体服务区、公共设施区 |
| | | |
| | | | |
| | |
| | | | |
| | | | |
生物洁净室主要的控制对象是微生物、病菌等活的有生命的粒子,是不断地生长、繁殖的粒子。它所产生的污染不仅仅是微生物本身,而且,还有它们新陈代谢产生的二次污染。生物洁净室主要应用在医疗、制药、食品、生物工程、实验动物饲养以及生物安全等行业之中。下面举例说明生物洁净室在医药、实验动物饲养、食品,医疗等行业中的应用。“药品生产质量管理规范”(GMP)中规定:药品生产的洁净厂房内的生产环境参数如:温度和相对湿度以及压差等均是由生产工艺决定的,一般温度为18℃~24℃,相对湿度为45%~65%。在“药品生产质量管理规范”(GMP)的实施指南中规定的比较具体。即药品生产洁净厂房中的温度和相对湿度是以穿洁净工作服的操作人员不产生不舒服、不舒适为基准的。
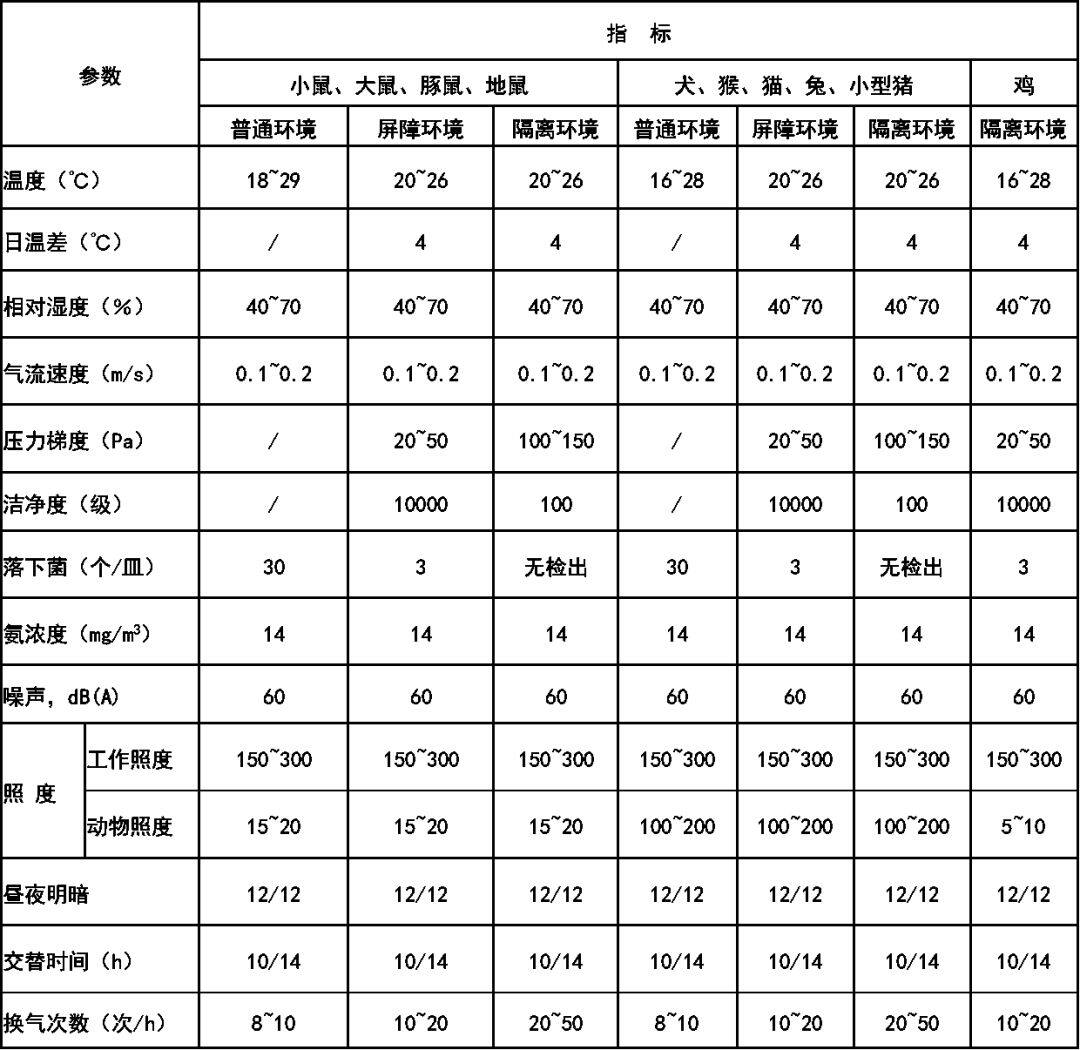
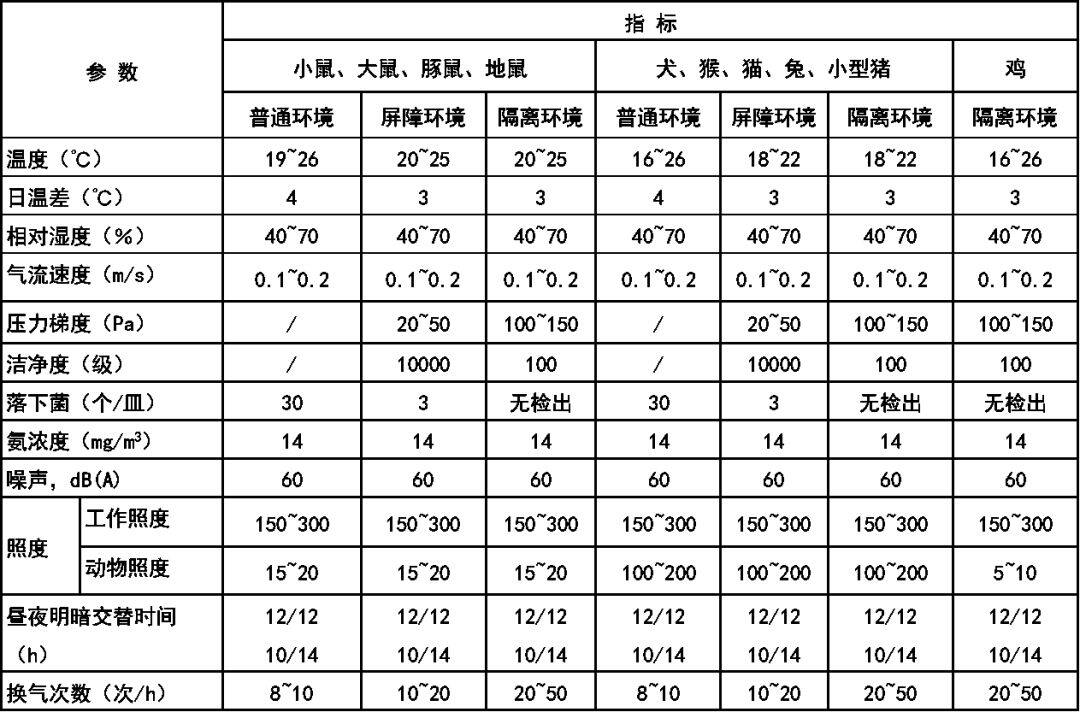
实验动物繁殖,生产设施以及动物实验设施(设备)的环境要求如下:实验动物繁殖,生产设施环境指标(静态)全新风保证有足够的新鲜空气量。如事先除去污染粒子和有毒有害气体,在同一单元内再循环空气不超过 50%;并保应有的温、湿度。单廊时必须保证饲育室和实验室的压力最高。动物实验设施(设备)环境指标(静态)全新风保证有足够的新鲜空气量。如事先除去污染粒子和有毒有害气体,在同一单元内再循环空气不超过 50%;并保应有的温、湿度。此处动物实验设备系指动物饲养和实验时,保障动物所处的局部环境应达到本环境指标的设备。前面有关实验动物的饲养、繁殖、生产的环境指标均摘自我国国家标准GB14925-2010《实验动物环境及设施》。食品卫生和食品生产的无菌洁净环境现已提到议事日程,其生产操作环境要求如下:
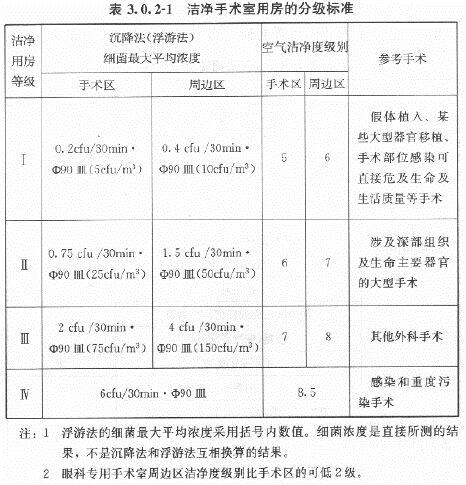
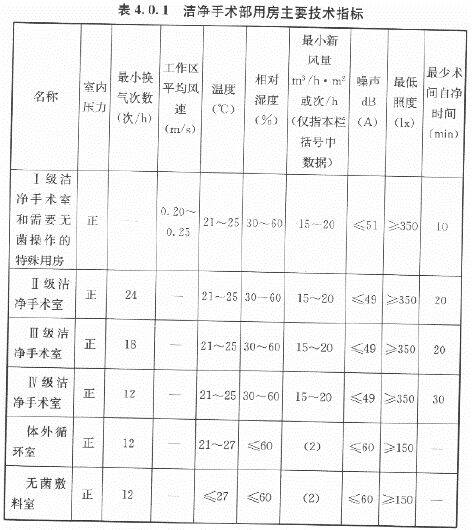
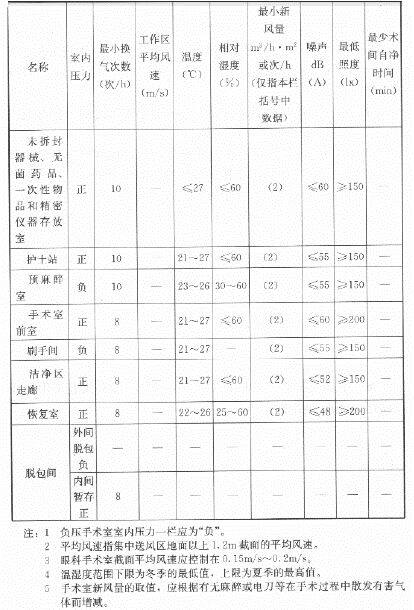
医院洁净手术部包括洁净区和非洁净区,在洁净区内又分有洁净手术室和洁净辅助用房。其环境要求如下:下表摘自《医院洁净手术部建筑技术规范》GB50333-2013,3.0.2规定如下:生物安全实验室是研究对人、动物、环境等有害感染性的微生物、病菌、病毒等的特殊环境条件。因此,生物安全实验室,必须作到绝对安全,不仅要保护实验研究对象,使实验得到真实可靠的实验数据和结果,而更重要的是保护实验操作人员和周围的环境,使实验人员和周围环境都能得到可靠的安全保障。根据世界卫生组织(WHO)的标准,可将感染微生物 的危险度等级依它们的危险程度不同划分为 4个不同的级别。而且不同危险度等级的生物安全实验室也要有相对应的生物安全水平。(A)根据我国农业部“兽医实验室生物安全技术管理规范”规定:Ⅲ级生物安全实验室的污染区、半污染区采用负压定向流全新风净化空调系统。不允许安装暖气、分体空调和电风扇。其室内温度为23±2℃,相对湿度为 40%~70%,噪声小于60dB(A),相对大气压清洁区为0Pa,半污染区为-25±10Pa,污染区为-50±10Pa。送风要经过高效过滤器,排风要经过两级高效过滤器过滤。洁净度要高于10000 级,采用顶送对面墙下回的气流组织,保证定向流,消除死角,并设有Ⅱ级或Ⅲ级生物安全柜。Ⅳ级生物安全实验室要进行500Pa正压密封试验,泄露<10%。(B)根据我国国家标准“生物安全实验室建筑技术规范”规定:(C)下表列出感染性微生物的危险等级和与微生物危险等级相对应的生物安全实验室的生物安全水平:
| |
| 不太可能引起人和动物致病的微生物,对个体和群体没有(或有极低的)。 |
| 病原体能够对人和动物致病,但对实验室工作人员、社区、牲畜或环境不易导致严重的危害,但实验室暴露也会引起严重感染,但是,有效的预防和治疗措施,且疾病传播的危险度有限。对个体有中度危险,对群体有低度危险。 |
| 病体通常能引起人或动物的严重疾病,但一般不会发生感染的个体向其他个体的传播。并且有有效的预防和治疗措施,对个体有高度危险,对群体有中度或低度危险。 |
| 病原体通常能引起人和动物的严重疾病。并且很容易发生个体之间的直接或间接的传播,对感染一般没有有效的预防和治疗措施,对个体和群体都有高度的。 |
| | | | |
| | | | |
| | | | 开放实验台,此外还需要GSC(生物安全柜)用于防护可能生成的气溶胶 |
| | | 在二级生物安全防护的水平上增加特殊的防护服,进入制度和定向气流 | |
| | | 在三级生物安全防护的水平上增加气锁入口, 出口淋浴,污染物的特殊处理 | Ⅲ级 BSC 或Ⅱ级 BSC 并穿正压服,双开门高压灭菌器(穿过墙体)、无菌的空气。 |
| |
| | | |
| | | | |
| | | | |
| | | | | |
| | | | |
| | | | |
| | | | |
| | | | |
| | | | |
| | | | |
| | | | |
| | | | |
| | | | | |
| | | | |
| | | | |
| | | | |
| 人员安全监控条件如:观察窗、闭路电视、双向通讯设备等 | | | | |
生物安全最重要的工作是对微生物危险度的评价,对微生物危险度的评价最关键的是列出微生物的危险度等级,但这还不够,还要考虑其他一些因素,其中包括:d,实验室操作所造成的其他感染途径(非消化道途径,空气传播,食入)。h,从动物研究的实验室感染报告或临床报告中获得的信息。i,计划进行的实验室操作(如:超声处理、气溶胶化、离心处理等)。j,可能会扩大微生物宿主范围或改变微生物对已知有效治疗方案敏感性的所有基因技术。 k,当地是否能进行有效的预防和治疗干预。由上述信息将可确定所计划开展的研究工作的生物安全水平的级别,选择由合适的个体防护设备,并结合其他安全措施来制定标准的操作规范,以确保在最安全的水平下开始实验研究工作。(D)生物安全水平等级不同的生物安全实验室,应针对危险度不同的微生物应具备最低的必要的安全防护措施和行为操作规范。根据世界卫生组织(WHO)的标准,将生物安全实验室的生物安全水平划分为四级。
| | |
| | 乱流为稀释原理,层流为活塞原理,送出的洁净室空气先达工作区,罩笼洁净工作区。 |
| | 除了一般空调的目的之外,更重要的是控制粒子的浓度。 |
| | 除空调手段外还要加高效、超高效过滤器,对微生物还要有灭菌措施。 |
| | |
| 一般降温500元/m2,一般恒温 800 元~1000 元/m2 | 单向流 5000~15000 元/m2,非单向流 1500~3000元/m2 |
| | |
| | |
| | |
| | |
| 主要是采取过滤方法。粗、中、高三级过滤,粗、中、高、超高四级过滤和化学过滤器等。 | 主要是采取:铲除微生物生长的条件,控制微生物的孳生、繁殖和切断微生物的传播途径。过滤和灭菌等。 |
| | |
| | |
| | 所有材料应耐水、耐腐且不能提供微生物 孳生繁殖条件。 |
| | 人进入要换鞋、更衣、淋浴、灭菌;物进入要擦拭、清洗、灭菌;空气送入要过滤、灭菌,人物分流,洁污分流。 |
| 灰尘粒子可用粒子计数器检测瞬时粒子浓度并显示和打印。 | 微生物检测不能测瞬时值,须经48小时培养才能读出菌落数量。 |
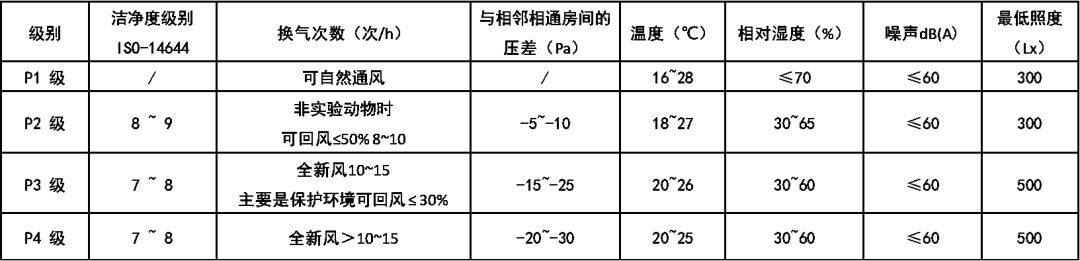
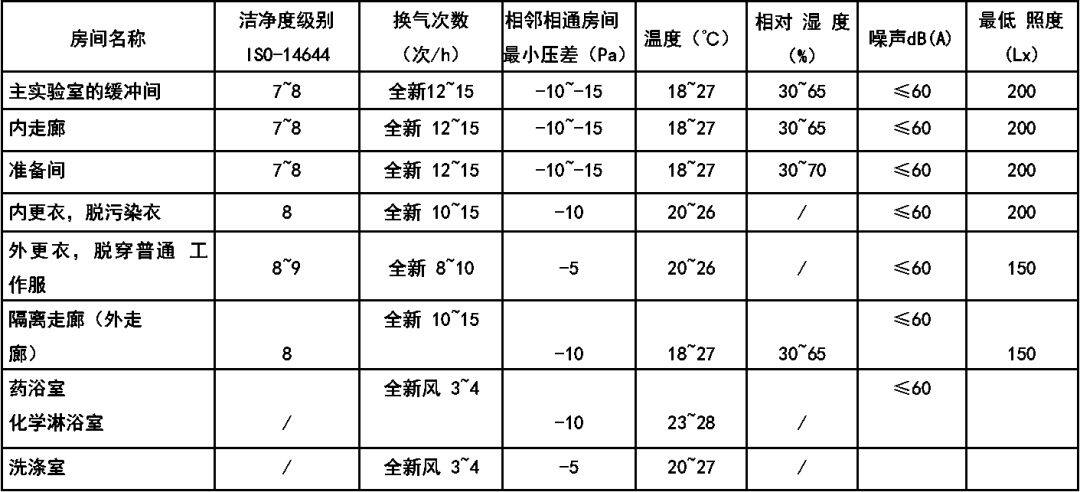
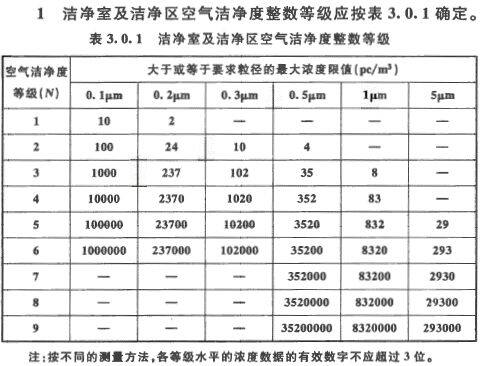
在我国“洁净厂房设计规范”GB 50073-2013 中对洁净室洁净度等级已做出了规定(见下表),这一规定是采用了国际标准ISO14644中的洁净度等级。目前,我国、欧盟、日本、俄罗斯 等国的洁净度等级均采用或参照上述国际标准来制订本国或本地区的洁净室洁净度的等级标准。美国也将本国的FS209E中洁净度等级标准修改为ISO14644 标准。洁净室及洁净区空气中悬浮粒子的洁净度等级(ISO14644)
② 本标准不适用表征悬浮粒子的物理、化学、放射及生命性。④ 根据要求粒径 D 的粒子最大允许浓度由下式确定(粒径 0.1μm~5μm)式中:N—为洁净度等级可在 1~9 级中间以 0.1 为最小单位递增量插入。CN—大于或等于要求粒径的粒子最大允许浓度(PC/m3),以四舍五入至近似的整数,有效位数不超过三位数。(五)洁净室的占有状态 洁净室的占有状态通常分为:空态、静态和动态三种。1、空态即洁净室已建成,净化空调系统正常稳定运行但洁净室内没有生产设备和没有人员 的状态。通常也称为竣工状态。空态验收也称作竣工验收。2、静态即洁净室已建成,净化空调系统正常稳定运行,生产设备安装完毕并按协商方式运 行,但室内没有操作人员的状态。静态验收也称为性能验收。3、动态即洁净室已建成,净化空调系统稳定运行并且进行正常生产的状态。动态验收也称 作使用验收。a、人是洁净室最大的污染源,规范进入洁净室内人员的着装和洁净室内人员的行为动作以控制人员的产尘。b、周围环境的污染空气的渗入加强维护结构的密封、堵漏,维持洁净室的正压。C、未经HEPA过滤的空气的送入对送入洁净室的空气要全部经过三级过滤,终端是HEPA过滤,安装过滤器要密封、检漏、堵漏。维持洁净室内的正压。d、围护结构的产尘和其他表面的产尘对围护的表面、顶、墙、地以及其他表面要定期擦拭、消毒和清扫。e、工艺设备和工艺过程的产尘对工艺的产尘要进行局部处理,避免污染扩散到全室。加强局部围挡和局部排风等。f、原材料、容器、水、气、溶剂以及外包装的产尘 外包装不应在洁净室内拆除。容器要进行消毒清洗处理,原材料要溯源到原材料的生产、供应、包装等情况。控制原材料、水、气和溶剂的净化来控制其带来的污染。g、在自然界和人们生活环境中存在有大量的微生物。例如;每克土壤中存在有 104~1010个微生物,每克水中存在有101~104个微生物,每克空气中存在有 104~106 个微生物,每平方厘米人的皮肤中存在有101~104个微生物,每平方厘米的地板中存在有 104~107 个微生物,而且微生物又是一种耐寒,耐热,抗辐射,抗紫外线照射,抗药能力很强的污染物。热原是微生物的代谢物,是一种难以去除的污染。热原的穿透力很强,能穿透过滤器的滤料;热原又能耐15℃的高温,灭菌难以杀灭热原。未去热原的注射液注射到人体后,人要发高烧,代谢紊乱,危害人的生命。① 人体每天脱落的表皮细胞大约 6~13 g/d。男人比女人多,年轻的比年老的多。统计每年每人脱落的表皮细胞多达 3.5~3.7kg/人·年。② 人体外层表皮单位面积(cm2)的微生物的量大约10000 个/cm2。③ 人打喷嚏产生的气溶胶粒子含有多达 100 万个微生物粒子。④ 人化妆产生的粒子一次高达5100×106个,其中:口红1100×106个;白粉 270×106个;红粉 600×106个;眼底 82×106个。⑤ 人所散发≥0.5µm 粒子每分钟高达 105~107个/分·人,每天高达10 亿个/日·人,人的 产尘随动作和穿衣的不同而不同。人员身穿洁净工作服而动作不同的产尘量(≥0.3 µm 的粒子)见下表(此表数据为美国污染控制协会提供)。
由上表可见,人的产尘量与人员在室内的行为动作有很大的关系。动作不同,其产尘量可差100倍或数百倍。因此要求在洁净室内工作人员要动作规范,不做不必要的动,不要“轻举妄动”。c、室内人员不同着装与产尘的关系:不同着装可分为洁净工作服的型式不同(大褂式、分体式、连体式等)和洁净工作服的材质不同(棉的确良、粗织尼龙、密织尼龙、电力纺、聚脂等);还有洗涤的方法不同等多因素,其产尘量的差别也非常之大。下表是1975 年~1978 年全国每一个超净实验室的实验数据,并作为我国第一篇洁净技术论文在国际大会上发表的数据(表中所测粒子粒径≥0.5µm)。
d、洁净工作服洗涤后的产尘,洁净工作服的洗涤方法和晾晒条件直接影响洁净工作服的发尘量,我们在实验室做实验,用普通自来水,一般洗衣粉,家用洗衣机对洁净服进行洗涤,洗完晾在普通的环境中,同时测试了该洁净服洗涤前后的产尘量。见下表。(表中所测粒子粒径≥0.5µm)。
由表可见,洗涤后的洁净工作服的发尘量超过洗涤前的2倍多。因此洗涤的方法和晾晒的条件对洗涤的质量影响非常大。我国2011年3月1日正式颁布和执行新一代的 GMP《药品生产质量管理规范(2010年修订)》,其目的是确保药品质量安全,促进我国医药经济结构调整和产业升级,进一步增强我国医药产业在国际市场的竞争能力,都有着重大的意义。a,强化人员管理:人员的资质,人员的分工,人员的职责和人员的培训等。提高了对从业人员的资质要求;明确了质量受权人、企业负责人、生产管理负责人、质量管理负责人均属生产企业关键人员,从学历、职称、工作年限等方面提高了对企业关键人员的要求。b,建立药品生产的质量管理体系:质量管理体系要确保药品质量符合予定用途的有组织,有计划的全部活动达标。c,引进了风险管理的概念并增加了相应的风险管理制度:如:新增加了对供应商的审计和批准、变更控制、偏差管理、超标调查和现场纠正措施以及产品质量回顾等各环节可能发生的风险的管理和控制。d,细化药品生产的操作规程:明确规定了药品生产过程的文件管理、生产管理、质量控制管理和质量保证管理的要求。a,规定了无菌制剂生产环境新的洁净度(粒子浓度和菌落数)(粒子浓度和菌落数)等级水平(A 级,B 级,C 级,D 级)。而且新的洁净度等级等同于 WHO 和欧盟最新的洁净度等级。同时还新增加了在线监测的要求,明确了对生产环境的悬浮粒子浓度的静态、动态的监测和对生产环境的微生物和表面微生物的验收和监测制度。b,增加了对环境、设施、设备的要求:规定了生产厂房的设计和布局应按生产区、仓储区、质量控制区、辅助区进行规划,对设施和设备的设计、安装、维护、使用、清洁等做了明确和具体的规定。3)强调了药品生产的要求:药品生产的全过程应与药品生产注册审批的要求的一致性。生产企业必修按注册批准的处方和工艺以及质量标准和检验方法进行生产和检验,药品方可放行。4)完善了药品的召回等监管措施:制定了药品的召回规程,确保药品召回工作的有效。召回的药品应立即向当地药品监管部门报告。
注:确认 A 级,每个测点的采样量不得少于1m3;洁净度为ISO4.8级,并以≥5.0µm 悬浮粒子的浓度为限度标准。D 级静态为ISO8级。动态可采用培养基模拟灌装过程以证明达到动态洁净度级别。洁净度A级用于高风险作业区,如:灌装区、放胶塞区、敞口包装容器区和无菌装配区等区域。其单向流区在工作区必须均匀送风,其风速为 0.36 m/s~0.54 m/s。C 级和 D 级用于无菌药品生产过程中工艺要求洁净较低的区域。
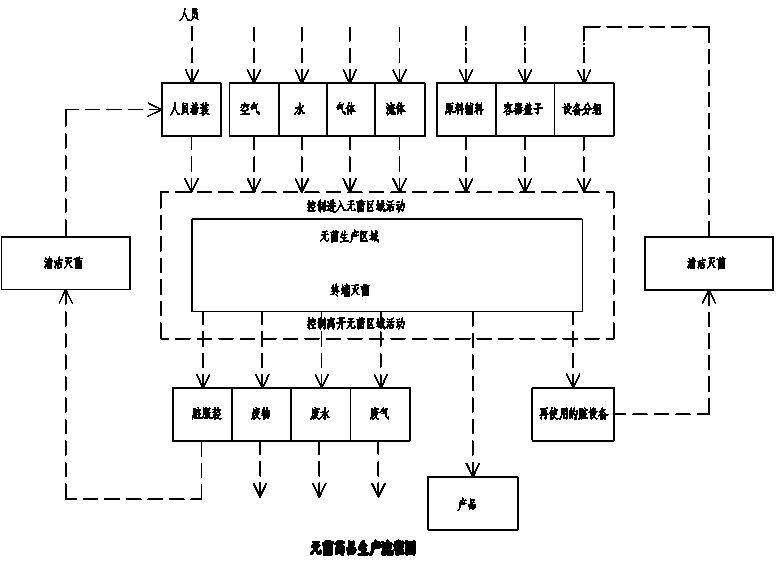
注:表中数值为均值。单个沉降碟的暴露时间可少于 4 h,同一位置可用多个沉降碟连续监测累积计数。GMP2010版药品生产洁净室的占有状态只规定只有静态和动态。不涉及空态。① 静态即所有生产设备均已安装就绪,但没有生产活动且无操作人员在场的状态。② 动态即生产设备按预定的工艺模式运行并有规定数量的操作人员在场操作的状态。2010版GMP规定不同洁净度等级的洁净室之间的压差应大于或等于10Pa,洁净室与室外之间的压差应大于或等于15Pa。4、GMP2010版规定生产工作结束,作业人员离开现场经过 15-20分钟自净后,洁净室的洁净度应达到静态等级标准。5、新版 GMP 规定洁净室的确认应分为:设计确认、安装确认、运行确认、性能确认和工艺验证五个部分。设计确认,应当证明厂房、设施、设备的设计符合予定用途和GMP要求。安装确认,应当证明厂房、设施、设备的建造和安装符合设计的要求。运行确认,应当证明厂房、设施、设备的运行符合设计的要求。性能确认,应当证明厂房、设施、设备在正常操作方法和工艺条件下能持续符合要求。工艺验证,应当证明一个生产工艺按规定的工艺参数能持续生产出符合予定用途和注册要药厂洁净室净化空调系统的设计对于保证药品生产的质量至关重要,药厂洁净室净化空 调系统的设计应最大限度地减少对药品的污染和交叉污染,为药品生产创造满足其生产工艺要求的受控环境,使之生产出合格的药品以确保人们身体健康和生命安全。1、收集并熟悉国家和地方有关药厂洁净室设计的标准和规范:医药工业洁净厂房设计规范 GB50457-2008民用建筑供暖通风与空气调节设计规范 GB50736-2012通风与空调工程施工质量验收规范 GB50243-2016建筑设计防火规范 GB50016-2014(2018版)2、该项目的“可行性研究报告”和“设计任务书”以及有关部门对项目批示;和当地消防 和环保部门对该项目有关防火和环保方面的要求;以及建设单位对项目建设的意见、建议和要求。3、该项目建厂地区的气象、水文、地质资料和周围大气污染的环境状况。4、该项目生产工艺对生产环境的要求和必要的有关生产工艺的数据和资料。① 药厂洁净室内工艺设备平面布置图和工艺设备清单。② 药厂生产的药品的种类和性质,药品生产工艺对环境参数的要求:洁净度、温度、相对湿度、噪声、照度、压力梯度…等。③ 生产设备的产热量、产湿量、产尘量、用电量、工艺冷却水量以及设备的同时使用系数。④ 生产设备的局部排风量,排风的性质(酸、碱、有机、粉尘、热…)以及排风环保达标的废气处理方法。⑤ 厂房洁净室的生产运行班次、运行规律以及生产的最大班人数。 5、洁净室的建筑和结构的资料。如建筑平面图、立面图、剖面图、房间的规划、房间的名 称;围护结构建筑材料的热工性能。建筑结构的单位面积承载力…等。6、药厂全厂的冷源、热源、电源的性质、参数和供应量。8、对于药厂洁净室内的温度和相对湿度而言,如果生产工艺对室内温、湿度没有特殊要求时,可按以下方法确定洁净室的温湿度。如果洁净室的洁净度级别为A级或B级,其温度可按20℃~24℃,相对湿度可按 45%~60%设计。如果洁净室的洁净度级别为C级或D级,其温度可按18℃~26℃,相对湿度可按 45%~65%设计。对于人身处理和生活用房冬季温度为 16℃~20℃,夏季温度为 26℃~30℃,相对湿度无要求。9、药品生产用洁净室的压力梯度应根据药品的性质和生产工艺来确定,当无特殊要求时,洁净室(区)和非洁净室(区)之间,不同洁净级别的洁净室(区)之间,必要时相同洁净度级别的不同功能的操作区之间也应当保持适当的压力梯度的静压差应≥10Pa,洁净室与室外的静压差应≥15Pa。青霉素类药品产尘量大的操作区应当保持相对负压。10、洁净室工作间的照度应≥300Lx,辅助用房的照度应≥150 Lx。11、洁净室的空态噪声单向流洁净室的噪声应≤65dB(A),非单向流应≤60 dB(A)。药厂的总平面应划分为:药品生产区、仓储区、质量控制区、辅助区、动力供应区、行政管理区、和生活区等七个功能区。总平面布置时应考虑人流、物流,以防止交叉污染。对于高致敏类药品(如青霉素等)或生物制品(如卡介苗)或其他用活性微生物制备的药品必须采用专用和独立的生产厂房而且不应影响其他药品生产厂房的生产工艺,一般均设在主导风向的下风侧。无菌制剂药品生产区的流程图如下:① 药品生产区应设置有:药品生产洁净室(洁净室、洁净走廊、人身净化、物料净化等部分)、动力用房(包括:配电站、水处理站、空调机房、排风机房等用房)和辅助用房。② 平面布局时首先要注意:防止人流物流交叉的污染,因此在进入洁净生产区之前要分别设置人身净化和物料净化的用房和措施。③ 洁净区不宜设电梯,电梯要有人梯和物梯之分;必要时电梯要设缓冲间。④ 为了管道布置的方便,节省空间,在平面布置时尽量将高级别的房间靠近空调机房,将温、湿相同相近的房间相对集中布置。而高致敏类药品生产用厂房要单独设生产厂房。⑤ 对于β-丙酰胺药品、中药的前处理、提取、浓缩和动物内脏清洗处理等用的生产厂房以及不同核素的放射性药品的生产厂房要与其他厂房分开设置。⑥ 口服液体和固体制剂、腔道用药、表皮外用药等非无菌制剂生产的暴露工序区以及直接接触药品的包装材料最终处理的暴露工序区,应当按D级洁净度的洁净区要求处理。对该区域采取适当的微生物监控措施。⑦ 血液制品的生产厂房应为独立建筑,不得与其他药品生产厂房共用。原料血浆的破袋、合并、分离提取、分装、灭活等工序至少在 D 级洁净度的洁净室进行。⑧ 平面布置时还应注意:将生产用菌种和非生产用菌种;生产用细胞和非生产用细胞;强毒与非强毒,死毒与活毒;脱毒前与脱毒后;活疫苗与死疫苗以及不同种类的血液制品,不同种类的预防药制品均不能在同一个生产区内加工和灌装。① 取样室宜设在仓储区内,其洁净度等级应与用其的生产区洁净室的洁净度等级相同。无菌取样室属无菌洁净室,其洁净度等级同其洁净室相同,并应设人身净化和物料净化用房。② 称量室宜设在洁净生产区内,其洁净度应与生产区相同。④ 清洗室宜设在洁净生产区外,其洁净度等级不应低于 8 级。若清洗室设在洁净生产区内,其洁净度应与生产区相同。无菌洁净室用的设备、工具、容器等在清洗之后应进行灭菌处理,灭菌后应放在无菌的环境中。⑤ 洁净室用的清洁工具,不宜放在洁净区内,若放在洁净区内其存放的房间其洁净度与洁净区相同。⑥ 洁净工作服的清洗、干燥、整理用房不应设在洁净生产区内,其用房的洁净度等级与用其生产区洁净室的洁净度等级相同。不同洁净度等级的洁净工作服应分开清洗、干燥、整理。无菌洁净工作服应用专用的设备清洗,洗后应灭菌而且应在 5 级洁净室内整理。⑦ 质量控制实验室应与药品生产区分开设置,并且还应按下述要求处理。阳性对照室、无菌检查室、微生物限度检查室、抗生素微生物检定室、放射性同位素检定室各实验室应分开设置。其中无菌检查室和微生物限度检查室属无菌洁净室,其洁净度不低于 7 级,同时应设置 人身处理和物料处理用房和措施。其中抗生素微生物检定室和放射性同位素检定室的洁净度不应低于8 级。4、对于防火等级甲、乙类用房与非甲乙类用房应分区或防火分隔。人是洁净室内最大的污染源。第一,人的新陈代谢过程会释放或分泌出大量的粒子和微生物;第二,人的表皮和服装上吸附和携带有大量的粒子和微生物;第三,人在洁净室内的行为动 作又会产生大量的粒子和微生物。因此,在进入药品生产洁净室之前必须进行必要的人身净化,尽可能去除人体表面(洗手、消毒)和服装(更衣)上的污染物。人员产生的污染物见下表。
| 人体每天脱落的表皮细胞大约 6~13 g/人·天。每人每年脱落的表皮细胞多达 3.5~3.7 kg/人·年。 |
| 人体外层表皮单位面积(cm2)上的微生物的量大约 10000 个/cm2。 |
| 人体打喷嚏产生的气溶胶粒子含有多达 100 万个微生物粒子。 |
| 人化妆产生的粒子一次高达 5100×106 个。其中口红 1100×106 个;白粉 270×106 个;红粉600×106 个;眼底 82×106 个。 |
| 人所散发的≥0.5 µm 的粒子每分钟高达 105~107个/分·人;每天高达10亿个/天·人。 |
① 人身净化用房及设施有:换鞋、脱外衣(一更)、洗手、穿洁净工作服(无菌工作服)(二 更)、消毒、气闸室等。不同洁净度等级的药品生产洁净室的人身净化用房应分开设置。洁净度相同的无菌洁净室和非无菌洁净室的人身净化用房也应分开布置。淋浴和厕所不应设在洁净生产区内,若设在人身净化区内(一更和二更之间)时一定要设缓冲间,并设有通风措施。人身净化用房的入口处应设净鞋(擦鞋、粘鞋垫)和换鞋(跨凳)措施。脱外衣和穿洁净(无菌)工作服的房间应分开,脱外衣房应设每人一柜。人身净化区和洁净生产区之间应设有气闸室,气流方向是从洁净生产区流向人身净化区。对于高致敏类药品(青霉素、某些甾体药品)、高活性药品和有毒有害药品应单独设人身净化用房,并采取防止有毒有害物带出人身净化房时的措施。更换洁净(无菌)工作服的房间应属洁净(无菌)房间,其洁净度等级建议如下:A、B 级洁净生产区的更洁净服房的洁净送风量为 15 次/时换气。C 级洁净生产区的更洁净服房的洁净送风量为 10 次/时换气。D 级洁净生产区的更洁净服房的洁净送风量为 8 次/时换气。① 原辅料、包装材料等物品的入口处设有物料净化用房和净化措施。② 进入洁净生产区的物料入口处应设有净化和消毒灭菌的用房,该房和洁净生产区之间应设有气闸室。来自暖通南社整理。③ 设置的物料传递室和传递柜应密闭而且易清洁,生产用过的废料应设专用传递设施且不应与物料进入的传递设施合一。1、药厂洁净室的净化空调系统 药厂洁净室的净化空调系统可采用全室净化空调方案或局部净化空调方案,也可采用全室净化空调加局部高级别净化空调方案。A,洁净室的送风至少要经过粗效、中效和高效三级过滤,粗效过滤器设在空调机组的新风入口处,中效过滤器设在空调机组的正压段,高效过滤器设在系统的末端。C,洁净室应有合理的压力梯度,维持洁净室的正压或负压。温湿度和洁净度相同或相近的洁净房间宜划为一个空调净化系统。温湿度和洁净度差别大的洁净房间,使用规律不同的房间的空调净化系统应分开设置。混合会产生污染和交叉污染的房间的空调净化系统应分开设置。无菌检查、微生物限度检查、抗生素微生物检定、放射性同位素检定的空调净化系统应分开设置。原料血浆实验室的空调净化系统应独立设置并使用专用设备。生产特殊性质药品如;高致敏性药品;强毒微微生物制品;芽孢杆菌制品等(如:青霉素)和生物制品(如:卡介苗或其他活性微生物制成的药品)的洁净房间应独立设空调净化系统。生产β-酰胺结构类药品、性激素类药品的房间应独立设空调净化系统。生产有某些激素类、细胞毒性类、高活性化学类药品房间应独立设空调净化系统。生产有某些放射性类,抗肿瘤类药品以及避孕药药品房间应独立设空调净化系统。血浆的融浆区、组分分离区以及病毒灭活后生产区应彼此分开,各自独立设置空调净化系统。血浆病毒去除和灭活后的制品应设专用生产区和专用设备独立设空调净化系统。避孕类药品、强毒性微生物及芽胞菌制品类药品的生产区要设立的空调净化系统。 有毒菌操作区应独立设置空调净化系统,系统不回风采取全排风直流系统。产生易燃易爆气体或粉尘的房间和场合应独立设置空调净化系统。产生有剧毒,有严重危害物的房房间和场合应独立设置空调净化系统。有可能通过系统的混药并有严重危害房间和场合应独立设置空调净化系统。有可能通过系统交叉污染并有严重后果房间和场合应独立设置空调净化系统。青霉素和高致敏性药品的精制、干燥和分装车间和场合的空调净化系统应为负压系统。强毒、致病微生物及芽胞菌制品车间和场合的空调净化系统应为负压系统。产生大量粉尘对相邻环境的洁净度构成危害的车间和场合的空调净化系统应为负压系统。药品洁净生产厂房的气流宜采取顶送下回或顶送下侧回的方式。对产生粉尘和有害物质的车间不应采取走廊回风的方式,也不宜采取顶回风的方式。单向流洁净室内不宜设置洁净工作台,非单向流洁净室设净化工作台宜远离回风口。排风口和余压阀宜设在送风气流的下风侧,以减少对送风气流的影响;室内产热宜减少对气流的影响。局部 A 级洁净生产区的垂直单向流应覆盖洁净的工作区的全部区域。垂直单向流应采取下回或侧下回方式,周围可用硬围挡或软围挡与周围隔开。垂直单向流工作区的气流应均匀,气流速度为 0.36 m/s ~0.54 m/s。④药厂洁净室空调净化系统的送风、回风和新风 药品生产用洁净室的送风量应是下面 4 个风量之中最大的风量:B、消除室内产生的余湿,保证室内相对湿度的空调风量。C、消除室内产生的污染,保证室内洁净度的净化风量。 D、补充排风量和维持室内正压的风量和保证室内人员大于40m3/h的新鲜空气量。E、送回风风管的风速:干管风速宜 7~9m/s,无风口支管风速宜 5~7m/s,有风口支管风速 宜 3~5m/s;F、风管的法兰垫片宜用大于5mm 厚的闭孔海绵橡胶;风管软管宜双层且外表面不能结露;风管设防火阀和消声器,消声器的长度应大于900mm。G、新风口应高出地面 2.5 米,和排风口的水平距离应大于 10 米,垂直距离应大于 2 米,新风口应设过滤器,新风口的风速应小于 5m/s。下述药品生产工艺的房间均采取全排风的直流系统,并且排风还须经过过滤(中效或高效过滤器)、吸附、除尘等有效处理,达到排放标准才能排到大气,以免污染环境。为了避免交叉污染,排风口还应设在空调净化系统新风吸入口的上方,并且距离要超过 5 米。散发粉尘的药品生产工艺且本身对粉尘不能有效处理的房间。产生大量有害物质、异味和挥发性气体的生产工艺房间。生产特殊性药品如高致敏性药品(青霉素)或生物制品(如卡介苗或其他活性微生物制成的药品)的房间。生产某些激素类、细胞毒性类、高活性化学类药品的房间。② 全排风生产工艺的房间应维持正压,但与周围相邻的房间还要维持相对负压。其生产区 还应采取防止气流扩散到其他相邻区域的措施;排放粉尘的生产工艺还应有除尘措施;有爆炸危险的除尘系统还应设泄爆和防静电的防爆除尘装置,而且排风机房间还应独立设置或设在室外。排风系统不宜过大,排风点不宜过多,一个排风系统不应跨两个空调净化系统。混合后产生火灾、爆炸、凝水、结晶的系统应分开设置。排放易燃易爆气体、有毒有害气体的应单独设置排风系统。④ 排风系统应设置防倒灌的措施;排放易燃易爆气体的排风系统应设防爆措施;排有凝结水的排风系统的管道要有坡度,最低点设排水措施;排放青霉素等工艺有害气体的排风还需经过HEPA过滤后达标排放;排放粉尘的排风系统要有除尘措施,还应有防爆炸、防静电的安全措施。⑤ 产生大量有害气体和爆炸性气体的房间应设置事故排风系统,事故排风系统的开关应设在方便操作的位置。⑦ 中药材和中药饮片的取样、筛选、粉碎、混合等工艺易产生粉尘,应设置有效处理和防扩散避免污染和交叉污染的措施,应设有集中除尘的排风系统和设备。药品生产用的洁净室与室外均应维持一定的正压,与其他相邻和周围的房间也应保持一定的压力梯度。若没有特殊要求时,洁净房间与非洁净房间、无菌房间与非无菌房间、高洁净度与低洁净度的房间之间均要维持≥10Pa 的正压。洁净室(区)与室外应维持≥15Pa 的正压。青霉素等特殊药品的精制、干燥、包装及制剂产品分装的房间。① 一般洁净生产区要采取两种以上的消毒灭菌方法。紫外线灭菌不能替代常规的化学消毒灭菌方法,化学消毒剂要经过无菌处理。② 薰蒸是最彻底的消毒灭菌方法,可以消除死角处的微生物的污染。但应确认薰蒸剂的残留水平。湿热灭菌(蒸汽和高压蒸汽):应监测蒸汽的压力、温度和灭菌的时间。干热灭菌(高温空气):高温空气一定要经过 HEPA 过滤,用于去热原时应监测灭菌腔内保持的温度、压力和灭菌时间。环氧乙烷灭菌:应控制环氧乙烷的浓度、灭菌腔内的压力和温、湿度。还要确认环氧乙烷对产品的影响。5、药厂洁净室用的空调机组 药品生产洁净室净化空调系统的空调机组应:③ 空调机组应无菌无水,排水快捷、通畅;加湿采用蒸汽。④ 空调机组要有很好的保温、隔热、绝缘、降噪、防冷桥性能。⑥ 空调机组的断面风速宜≤2 m/s;有防带水措施。① 洁净室内的热负荷计算,洁净室的热负荷包括下列各项:围护结构的传热负荷计算:Q传=ΣKi Fi△t(KW)人员的显热负荷:Q 人显 = n·q 人显(kW)人员的潜热负荷:Q 人潜 = n·q 人潜(kW)人员的全热负荷:Q 人全 = Q 人显+ Q 人潜(kW) n0— 整流器消耗的功率系数(n0=1.0~1.2)n1— 安装系数(明装 n1=1.0,暗装 n1=0.6~0.8 )
总显热负荷:Q显=Q传+Q人显+Q灯+Q设+QFFU总全热负荷:Q显=Q传+Q人全+Q灯+Q设+QFFU② 洁净室内的湿负荷计算 洁净室的湿负荷包括下列各项:w设— 产湿设备单位面积的水蒸发量(kg/m2·h) 表6 不同温度条件下成年男子的散热(W)、散湿(g/h)量表
洁净室的送风量不仅仅能消除洁净室的总的余热,余湿以保证洁净室的温度和相对湿度;而且,洁净室的送风量还应能消除室内产生的灰尘等粒子的污染,以保证洁净室的洁净度等级。因此,洁净室的送风量应为消除余热的送风量,消除余湿的送风量和消除粒子污染的净化送风量三者之间最大的送风量为该洁净室的送风量。式中:Q 显,Q 全—分别为洁净室的显热和全热负荷(kW)在一般情况下,由于室内产尘量 G 很难准确,因此,在工程中都不用上述公式计算送风量。而采用断面风速法(单向流洁净室)和换气次数法(非单向流洁净室)进行净化送风量的计算。
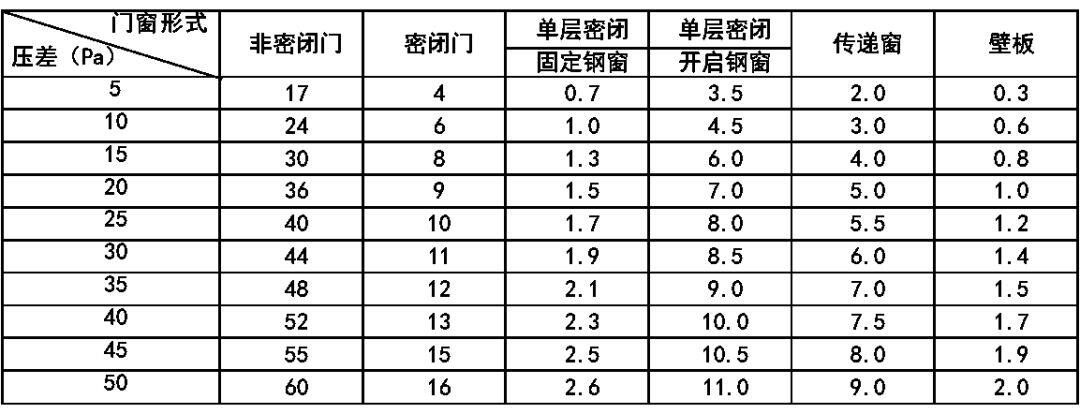
注:表中换气次数适应于层高小于 4.0m 的洁净室。室内人员少、热源少时,宜采用下限值。洁净室的新风量不仅仅要补充洁净室的排风量和维持洁净室正压的泄漏风量,同时还要保证洁净室内工作人员每人每小时不小于40m3的新鲜空气量的要求。因此:排有毒气体 V = 0.5~0.8 m/s(有三面围挡),V= 0.8~0.9 m/s(有二面围挡);V= 0.9~1.1 m/s(有一面围挡),V= 1.1~1.3 m/s(无围挡)。通风柜工作口的排风速度宜按以下数据计算:排无毒气体 V=0.35~0.45 m/s;式中:q— 单位缝隙长度的漏风量可查表九(m3/h·m)表9 围护结构单位长度缝隙的渗漏风量表(m3/h·m)
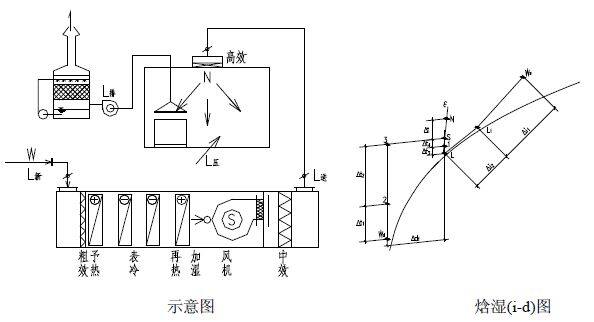
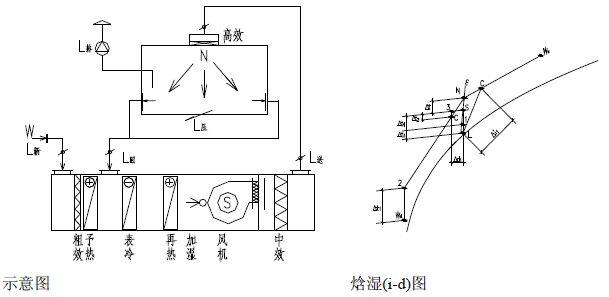
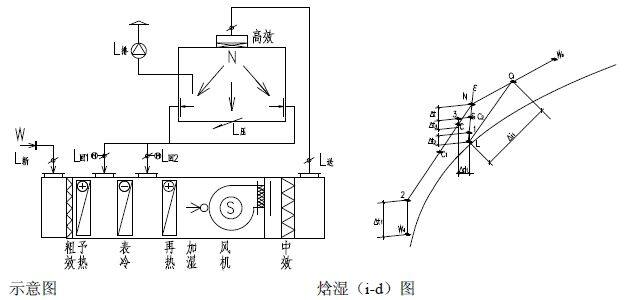
3、水力平衡计算:总阻力等于摩擦阻力与局部阻力之和。全新风净化空调送风方案是用于特殊的不允许回风的洁净室的送风方案中。如:洁净室内工 艺生产类别为甲、乙类火灾危险等级或工艺过程产生有剧毒等有害物不允许回风的洁净送风系统中。其原理图和焓湿图如下。图23 空调机组(AHU)全新风空气处理方案示意图及焓湿图一次回风的送风方案多用在洁净室内的发热量或产湿量很大,消除室内余热或余湿的送风量大于、等于或近于净化送风量的低洁净度等级的非单向流洁净室中。此方案的原理图和焓湿图如下:图24 空调机组(AHU)一次回风空气处理方案示意图及焓湿图为了节能、消除空气热湿处理过程中的冷热相互抵消,在洁净室净化送风量大于其消除余热、余湿的空调送风量时,最好采用一、二次回风方案,将二次混合点设计在系统送风点上,该方是最节能、最经济的送风方案。其原理图和焓湿图如下:图 25 空调机组(AHU)一、二次回风空气处理方案示意图及焓湿图为了节能、消除空气热湿处理过程中的冷热相互抵消,在洁净室净化送风量大于其消除余热、余湿的空调送风量时,最好采用一、二次回风方案,将二次混合点设计在系统送风点上,该方案是最节能、最经济的送风方案。其原理图和焓湿图如下:图25 MAU加 RAU 空气处理方案示意图及(i-d) 图(六)空调净化系统的总冷量、总热量、总加湿量的计算A.过滤器的分类:按过滤器的性能(效率、阻力、容尘量)进行分类,根据我国有关规范可将过滤器划分为粗效、中效、高效、亚高效、高效和超高效六大类。见表 11、表 12。根据我国“空气过滤器”GB/T14295-2008国家标准划分根据我国“高效空气过滤器” GB13554-2008国家标准划分。表12高效过滤器和超高效过滤器的效率和阻力:我国过滤器分类与欧美国家分类的比较表,见表 13。对于空气过滤器的效率而言,相同的过滤器其效率的测试方法不同它们的效率的值也不相同,因此使用过滤器时不仅仅要了解其过滤效率,而且还要知道它们效率的测试方法。1, 一般通风用粗效、中效、高中效过滤器效率的测试方法计重法:有人工尘计重法和大气尘计重法,此方法源于美国,国际流行,多用于粗效过滤器的效率测试。比色法:源于美国,国际通行,用于中效过滤器的效率测试。人工尘计数法:欧洲通行,将取代比色法,用于中效测试。MPPS 法:欧洲标准将取代上述各种方法(最低透过率粒径法)。C.各类空气过滤器的功能和作用:各种过滤器都具有一定的功能,都不是万能的。它的功能就决定了它的作用和使用范围。对其选用正确,使用合理,它们就能充分发挥功能,起到应起的作用;如果选用不当,使用不合理,不仅不能发挥其作用,有时还会产生相反的后果。它们的功能和作用如下:粗效过滤器:其功能是去除≥5μm 的尘埃粒子,在空调净化系统中作为预过滤器。其作用是保护中效,高效过滤器和空调箱内的其他配件以延长它们的使用寿命。中效过滤器:其功能是去除≥1.0μm 的尘埃粒子,在空调净化系统中作为中间过滤器。其作用是减少高效过滤器的负荷,延长高效和空调箱内配件的使用寿命。高中效过滤器:其功能是去除≥1.0μm 的尘埃粒子,在空调净化系统中作为中间过滤器,在一般通风系统中可作为终端过滤器。亚高效过滤器:其功能是去除≥0.5μm 的尘埃粒子,在空调净化系统中作中间过滤器,在低级净化系统中可做终端过滤器使用。高效过滤器:是空调净化系统中的终端过滤器,它的功能是去除≥0.3μm 的尘埃粒子,达到净化目的。是洁净室必备的净化设备。超高效过滤器:其功能是去除≥0.1μm 的尘埃粒子,是建造高级别洁净室(0.1μm 洁净室)的必备净化设备,是该洁净室的终端净化设备。选空调机组 空气处理机组包括空调器(AHU)、新风机组(MAU)和循环机组(RAU),都是空调净化系统常用的空气热湿交换和空气净化处理设备。A.工业洁净室用空调机组 工业洁净厂房的空气处理机组是服务于净化空调系统的,因此空气处理机组也必须满足净化空调所需的特点。1,洁净厂房的温、湿度和洁净度要求严格,一般情况室内热负荷很大、空气处理的焓差很大、冷却后的空气的露点温度很低,因此空气处理机组的保温性能要好(保温材料为聚苯乙烯或聚氨脂发泡时保温层厚度σ≥40mm),防止表面结露,冷耗过大;同时还应避免冷桥现象的产生。2. 因净化空调系统总阻力较大,故要求空调机组的风机压头很高(≈1500Pa),因此随之要求空调机组围护板壁的强度和刚度要好,不要产生负压段凹进去,正压段凸出来的变形。3. 为了减少冷损失和漏风,则要求空调机组的密封性能好,特别是段与段的联接处和门开启处的密封。按标准要求空调机组的漏风率≤1%。4. 为了保证洁净厂房的温、湿度和洁净度,并且尽量节省能量,要求空调机组有较好的自动控制,如风机的变频等。又因为空气的冷、热、湿处理的功能较多,故空调机组体形较大、长度较长。生物洁净室是以微生物(细菌、病毒等)为主要研究对象的,微生物与尘埃粒子不同,它是活的、不断生长繁殖的粒子,因此服务于生物洁净室的空气处理机组应具备如下特点:1.为了方便灭菌、消毒、空调机组的内表面以及内部的零配件应耐消毒药品的腐蚀,表面要光洁。2.因为潮湿是微生物生长的最佳条件。因此,空调机组内部不能集水集尘,结构要方便排水;表冷器凝结水应设有自动防倒吸功能,并顺利排出凝结水;更不能采用淋水段。3. 空调机组的加湿只能采用干蒸汽加湿器(电极式或电热式蒸汽加湿器),而不能使用湿膜、 超声波和高压喷雾等有水的加湿器。4.为了防止空气带水,空调器表冷器的断面风速 V <2.0m/s。7.各级(粗效、中效、亚高效)过滤器的过滤效率要高,而且最好采用一次性的抛弃型过滤器。1.表冷器是空调机组降温去湿的关键设备,一般表冷器由铜管和铝翅片构成。表冷器的换热面积(排数)要经计算求得,在设计中,设计人员要把空气经表冷器处理前后的参数(温度、相对湿度或焓)以及冷冻水的供回水温度提供给供货商,由供货商计算和配置表冷器。表冷器后面要设挡水板,表冷器下部设滴水盘,凝结水排水要通畅,排水管上要合理地设置水封。水封的高度要与空调器内的压力相匹配。2, 加热器是空调机组中的加热设备。在空调机组中有一次加热(预热)和二次加热(再热)两组。加热的热媒有蒸汽、热水和电。a. 一次加热(预热)器设置在新风进入空调机组处,其目的是为了防冻和防混合结霜、结雾。因此,一次加热器一般用在北方(长江以北)较冷的地区。长江以南不会结冻的地区可不设一次加热器。一次加热后的新风温度一般为+5℃。用加热器后的温度探头来控加热量。一次加热的热媒最好是蒸汽和电,如果用热水做热媒要考虑加热器本身的防冻问题。b. 二次加热(再热)器设在表冷器之后,设置目的是为了调节洁净厂房内的温、湿度以达到设计参数。因为,二次加热量越小就越节省空调的运行费用,故在设计时要选择二次加热量较小的节能方案。二次加热的热媒最好用热水,因为热水在温、湿调节时比较稳定可靠。c. 当洁净厂房的温、湿度精度要求极高和非常严格时,为了确保其参数有时在风管上还要设置微调的电加热器。3,加湿器是空调机组中的加湿设备,在冬季时为了保证洁净厂房内必要的相对湿度,必须对空调送风进行必要的加湿。加湿器一般有两种,一种是以水为加湿源的等焓加湿。如湿膜、淋水、超声波、高压喷雾等加湿器。这种加湿方法简单、价格便宜,加湿量也大,但其加湿的精度较差。一般相对湿度要求在>10%的情况下用得较多。水加湿的方法不应用在生物洁净室。因为,水加湿会给微生物提供良好生存繁殖条件。另一种加湿方法是以蒸汽为加湿源的等温加湿。如蒸汽加湿器、干蒸汽加湿器、电极式(电热式)蒸汽加湿器等。这种加湿方法必须有蒸汽源,如果没有蒸汽必须用电来产生蒸汽。此种加湿方法价格较高,但加湿精度很高,当相对湿度要求≤±5%时应采用等温加湿方法。它广泛应用在电子工业的洁净厂房和生物洁净室的加湿中。① 淋水室是空调热湿交换的空气与冷媒直接接触的方式。此种淋水形式不仅可用于热湿交换上,还可以对新风进行品质上的处理。例如,集成电路用的洁净厂房其污染源不仅仅是尘埃粒子,而且,重金属离子和分子级低浓度的化学污染也成为超大规模集成电路生产的重要污染源,当净化空调系统的新风采用淋水室的湿法处理时,可以去除新风中的 NH4、SO4、NO3 等分子级的化学污染,当采用自来水和纯水两级淋水时其效果会更好。② 活性碳过滤器和化学过滤器是空调机组中去除异味和分子级低浓度的化学污染的重要设备,一般多用在新风机组中。洁净厂房的噪声按国家规范“洁净厂房设计规范”(GB50073-2013)的规定,单向流洁净室空态噪声≤65dB(A);非单向流洁净室空态噪声≤60dB(A)。这就要求在净化空调系统的送风、回风管道上(排风管道上)都要设置必要的消声设备,尤其在回风管道上。消声器的选择要进行计算。ΔL =LW-ΔL管道-ΔL风口-ΔL室内 -LNLN —室内允许的噪声值(dBA) 洁净厂房的净化空调系统的消声器和消声弯头不应给净化系统带来污染。最好采用微孔板式消声器和消声弯头,也可选用其他洁净空调系统专用的阻式或抗式消声设备。一、施工图主要设计文件有:图纸目录、设计与施工说明、设备表、计算书和图纸。① 设计说明:主要介绍设计概况、设计依据、设计范围、室内外的参数,冷、热媒的来源和参数,采暖、通风、空调、净化系统的冷、热、湿负荷的指标和系统方案及其控制方法。② 施工说明:说明设计中使用的材料、附件、系统的工作压力和试验压力以及施工安装的要求和注意事项。3、设备表 设备的名称、规格型号、技术参数、数量、服务对象。 采暖平面图的散热片位置、片数、管道位置和主管编号、管道配件、干管标高坡度坡向。通风空调净化风管画双线,水管画单线,管道的管径、安装标高、设备和管道、风口的大小和定位尺寸,管道的配件如消声器、防火阀、调节阀等规格型号。② 剖面图:在管道多、交叉多的平面图表示不清楚的地方画剖面图,剖面图要给出设备、 管道等与建筑的板、柱、梁、地之间的人才关系,注明设备、管道、配件的尺寸和标高。5、计算书的内容,包括:空调净化的负荷计算书;风量计算书、管道的水力计算书;设备(制冷机、空调器、冷却塔、水泵风机等)的选择计算书等。所有图纸中,净化空调原理图和净化空调自动控制原理图非常重要的图纸,它能反映出设计的全部内容。如:系统型式,冷、热量大小,节能优化,室内的温湿度、洁净度等重要内容。1,药品生产企业的确认:是证明厂房、设施和设备正确运行并达到予期效果的一系列活动。2,药品生产企业的验证:是证明任何操作规程(方法),生产工艺或系统均能达到予期效果的一系列活动。1、设计确认:设计确认是要证明厂房、设施和设备的设计符合预定的用途和“药品生产质量管理规范”的要求。2、安装确认:安装确主人是要证明厂房、设施和设备的建造和安装符合设计标准,满足生产工艺的要求。3、运行确认:运行确认是要证明厂房、设施和设备的稳定、可靠的运行并符合设计的标准。4、性能确认:性能确认是要证明在正常操作方法和正常工艺条件下厂房、设施和设备能持续保证其性能并符合设计标准。5、工艺验证:应证明一个生产工艺按规定的工艺参数能持续生产出符合预定用途的注册要 求的药品。1、对关键作业区即洁净度 A 级和 B 级区的动态进行全过程的监测。监测的频率应能及时发 现生产过程中产生的问题。如:人为的干预、偶发的事件以及其他问题。对于洁净度 C 级 和 D 级的区域必要时进行动态监测。3、动态监测微生物的最大允许数,常用沉降法、定量空气浮游菌法和表面取样法。(四)对药品生产工艺进行验证 工艺验证应证明一个生产工艺按规定的工艺参数能持续生产出符合预定用途的注册要求的药品。(1)洁净室的风量,包括送风量,回风量,新风量,排风量;(3)洁净室内的洁净度,包括粒子浓度,微生物最大允许数;新的“药品生产质量管理规范”(2010年修订)即新的GMP的附录中给出五种药品:无菌 药品、原料药、生物制品、血液制品和中药制剂。1,无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药。即无菌制剂以及无菌原料药。包括非经肠道制剂、无菌软膏剂、眼膏剂、混悬剂、滴眼剂等。根据生产工艺无菌药品又分为:采用最终灭菌工艺的最终灭菌产品和部分或全部工序采用无菌生产工艺的非最终灭菌产品。2,无菌药品的生产必须满足其质量和用途要求,最大限度地降低微生物、粒子和热源的污染。(对全部工序要进行全过程的质量保证,不能只依赖形式上的最终成品检验。)3,为了防止污染和交叉污染,生产人员、设备和各种物料必须通过气闸室(缓冲间)方能进入洁净生产区;其中物料准备、产品配制、灌装和分装等操作必须在洁净生产区内进行。
洁净度A 级用于高风险作业区,如:灌装区、放胶塞区、敞口包装容器区和无菌装配区等区域。其单向流区工作区必须均匀送风,其风速为 0.36 m/s ~0.54 m/s。确认 A 级,每个测点的采样量不得少于1m3;洁净度为 ISO 4.8 级,并以≥5.0µm 悬浮粒子的浓度为限度标准。采样管的长度要短,以勉≥5.0 µm 的粒子沉降,影响测试结果。单向流应采用等动力采样。洁净度 B 级用于洁净度 A 级区域的背景区域。静态洁净度为 ISO 5 级。C 级和 D 级用于无菌药品生产过程中工艺要求洁净较低的区域。C 级静态和动态分别为ISO 7 级和ISO 8 级。D 级静态为 ISO 8 级。动态可采用培养基模拟灌装过程以证明达到动态洁净度级别。2010版 GMP 规定生产工作结束,作业人员离开现场经过 15-20 分钟自净后,洁净室的洁净 度应达到“静态”标准。日常动态监测项目:洁净度、温度、相对湿度、压力梯度等。微生物的日常动态监测方法:沉降菌法、定量空气浮游菌采样法、表面取样法等。C 级背景下的局部 A 级;(1)高污染风险产品(产品容易长菌、灌装速度慢、灌装容器 为广口瓶、容器须暴露数秒后方可密封等)的灌装(灌封)。C 级;(1)产品的灌装(灌封)。(2)高污染风险产品(产品容易长菌、配制后待较长时间方可灭菌、不在密闭系统中配制等)的配制和过滤。(3)眼用制剂、无菌软膏剂、无菌混 悬剂等非配制和灌装(灌封)。(4)直接接触产品的包装材料和容器最终清洗的处理。D 级;(1)轧盖。(2)灌装前物料的准备。(3)产品的配制(浓配或密闭系统中配制等)和过滤。(4)直接接触产品的包装材料和容器最终清洗的处理。B 级背景下的局部 A 级;(1)处于未完全密封(轧盖前的产品)状态下产品的操作和转运,如:产品的灌装(灌封)、分装、压塞、轧盖等。(2)灌装前无法除菌过滤的药液或产品的配制。(3)直接接触产品的包装材料和容器灭菌后的装配及处于未完全密封状态下的转运和存放。(4)无菌原料药的粉碎、过筛、混合、分装。B 级;(1)处于未完全密封状态下的产品置于完全密封容器内的转运。(2)直接接触产 品的包装材料和容器灭菌后的置于完全密封容器内的转运和存放。C 级;(1)灌装前可除菌过滤的药液或产或产品的配制。(2)产品的过滤。D 级;(1)直接接触产品的包装材料和容器最终清洗、装配或包装、灭菌。1,进入洁净生产区内人数应当严加控制。无关人员不得进入洁净生产区。2,凡进入洁净生产区人员应当定期培训。培训内容包括洁净知识、卫生和微生物方 面的基础知识。3,当人员由于健康状况可导致微生物污染风险增大时,应采取适当措施。4,进入洁净生产区内人员按操作规程进行更衣、洗手和消毒。工作服的质量、式样和穿着方式应与生产操作的要求和操作区的洁净级别相适应。A/B 级洁净区;用头罩把头发和胡须等全部遮盖,头罩塞进衣领内,戴口罩、手套和防护目镜。穿灭菌消毒的脚套,裤子塞进脚套内,袖口塞进手手套内。工作服应为灭菌连体工作服。C 级洁净区;应把头发和胡须等全部遮盖,戴口罩,工作服应为灭菌连体工作服或分体工作服,穿适当的鞋子或鞋套。D 级洁净区;应把头发和胡须等全部遮盖,穿适当的工作服、鞋子或鞋套。5,工作服应按操作规程进行清洗、灭菌。洗衣房宜单独设置。1,洁净厂房设计,应尽量避免管理和监管人员不必要的进入洁净生产区,可由外部观察。2,为了防止污染和交叉污染,洁净生产区根据生产的产品性质,分别维持必要的正压或负压。设送风机事故报警系统。3,A/B 级洁净区内禁止设水池和地漏。其他洁净区可适当设水池和地漏,而且,应方便清洁,有阻气的功能和防倒灌措施。4,更衣室要分一更和二更,一更为更外出服室,二更为更洁净工作服室。5,人员、物料进入洁净生产区必须通过气闸(缓冲)室,气闸(缓冲)室设有不能同时开启的两道门。6,产生大量粒子的生产工序和设备要设独立的排风系统。1,未经灭菌的传送带不得在 A/B 级洁净区与低级别洁净区之间穿越。2,生产设备和辅助装置的设计和安装应方便在洁净区外进行操作、保养和维修。3,洁净区的空气净化系统应保持连续运行,维持相应的洁净度等级,因故停机后在开启时应确认能达到规定的洁净度等级,对该区进行必要的清洁、消毒、灭菌,监测合格方可重新生产。4,关键设备,如:灭菌柜、空气净化系统、工艺用水系统,工艺用气系统等,应经确认和批准方能使用。5,过滤器不应脱落纤维。过滤器不得与产品发生反应,释放污染对产品质量有不利影响。1,按操作规程对洁净区进行清洁和消毒,消毒剂的种类应多于一种,不得用紫外线替代化学消毒。2,应监测消毒剂和清洁剂的微生物污染状况,消毒剂和清洁剂应放在清洁容器内,不 得过期使用。A/B 级洁净区用无菌的消毒剂和清洁剂。3,必要时,可采用熏蒸方法降低洁净区内的卫生死角的微生物污染。4,灭菌可采用湿热灭菌、干热灭菌、离子辐射灭菌、环氧乙烷灭菌和过滤除菌等方式进行灭菌,每一种灭菌方式都有其特定的适用范围。5,任何一种灭菌方式使用前,必须采用物理检测手段和生物指示剂,验证其适用性及达到灭菌效果。7,使用生物指示剂时,应有严格的管理措施,防止由此所致的微生物污染。(一) 附录2 适用于非无菌原料药的生产及无菌原料药生产中非无菌生产工序的操作。(二) 非无菌原料药精制、干燥、粉碎、包装等生产操作的暴露环境应安 D 级洁净区 的要求设置。(三) 标准中有热源或细菌内毒素等检验项目的厂房设计应特别注意防止微生物的污染。(四) 原料药的质量标准应包括对杂质的控制(如:有机杂质、无机杂质、残留溶剂)。有微生物或细菌内毒素控制要求的,还应有相应的标准。(五) 原料药应按经验证的操作规程进行病毒去除和灭活。应采取必要的措施,防止病毒去除和灭活操作后可能的病毒污染。敞口操作区应与其他操作区分开,并设独立的净化空调系统。(六) 原料药生产的验证包括生产工艺的验证和清洁验证。1, 微生物和细胞培养,包括 DNA 重组或杂交瘤技术。(二) 生物制品是指:细菌类疫苗(含类毒素)、病毒类疫苗、抗毒素及抗血清、血液制品、细胞因子、生长因子、酶的体内体外诊断制品以及其他活性制剂,如:毒素、抗原、变态反应原、单克隆抗体、抗原抗体复合物、免疫调节剂及微生态制剂。(三) 对生物制品的生产过程和中间产品的检验应进行特殊控制。1, 对管理、生产、质保、维护等人员应进行专业知识和安全防护要求的培训。2, 对管理、生产、质保、维护和动物饲养等人员接种相应的疫苗,并定期体检。3, 有传染病、皮肤病及皮肤有伤口者,对产品质量和安全有影响的人员,均不得进入生产区进行操作或检验。4, 进行生产操作的人员应与动物饲养人员分开,不得兼任。1, 生物制品生产环境的洁净度级别应与产品和生产操作相适应。涉及高危因子的操作,其空气净化系统等措施还应符合特殊要求。B 级背景下的局部 A 级;(1)无菌药品中非最终灭菌产品非最终灭菌产品规定的各工序。C 级;体外免疫诊断试剂的阳性血清的分装、抗原与抗体的分装。D 级;(1)原料血浆的合并、组分分离、分装前的巴氏消毒。(3)酶联免疫吸附试剂等体外免疫试剂的配液、分装、干燥、内包装。3,生产过程中使用某些特定活生物体时应根据产品特性和设备采取相应的防止交叉污 染的措施(用专用厂房和设备、阶段式生产方式、用密闭系统等)。4,卡介苗和结核菌素生产厂房必须与其他制品的活生物厂房严格分开,涉及活生物的设备应专用。5,无菌制剂的生产加工区域应符合洁净度级别的要求,并保持正压。操作有致病作用的微生物应在专门区域内进行,并保持相对负压。其周围环境应为正压洁净区。6,有菌(毒)操作区应有独立的空气净化系统,来自病原体操作区的空气不得循环使用。来自危险度二类以上病原体操作区的空气应除菌过滤后排放。7,用来处理活生物体的生产操作区和设备应方便清洁和除去污染。8,管道系统、阀门和过滤器应方便清洁和灭菌。宜采用在线清洁和在线灭菌系统。9,洁净区内设置的冷库和恒温室,应采取有效的隔离和防止污染的措施。(一) 附录 4 中的血液制品特指人因浆蛋白类制品;并规定适用于人血液制品的生产、质量控制、贮存、发放和运输。1, 血液制品的生产厂房应为独立的建筑物,不与其它药品共用。并使用专用设备。2, 原料血浆检验实验室应独立设置,并使用专用设备,并应有原位灭活或消毒设备。其应有独立的空气净化系统。3, 原料血浆破袋、合并、分离、提取、分装前的巴氏灭活等工序至少在 D 级洁净区内进行。4, 血浆融浆区域、组分分离区域及病毒灭活后生产区域应彼此分开,并使用专用设备,各区域应有独立的空气净化系统。5, 血液制品生产中,应采取措施防止病毒去除和灭活前、后的交叉污染。病毒去除和 灭活后的制品应使用专用的生产区域和专用设备。并有独立的空气净化系统。(一)附录 5 适用于中药材的前处理、中药提取和中药制剂的生产、质量控制、贮存、发放和运输。1,中药材和中药饮片的取样、筛选、称重、粉碎、混合等操作易产生粉尘,应采取有 效的控制粉尘扩散,防止污染和交叉污染的措施(排风、除尘等)。3, 中药提取、浓缩、等生产厂房应与其生产工艺要求相适应,应有良好的排风、水 蒸汽控制及防止污染和交叉污染的措施。4, 中药提取、浓缩、收膏等生产工序宜密闭进行操作,并在线清洁以防止污染和交叉污染。采取密闭系统生产其环境可为非洁净区,采取敞口方式生产其环境应与其制剂配制要求的洁净度相适应。5,中药注射剂浓配前的精制生产工序至少应在 D 级洁净区内进行。