如何建设PCR实验室
与PCR实验室建设相关的指导文件主要有四份:
《医疗机构管理条例》
《医疗机构临床实验室管理办法》
《临床基因扩增检验实验室管理暂行办法》
《医疗机构临床基因扩增实验室管理办法》
临床PCR实验室,不但在实验室设置及仪器设备等硬件上要满足开展临床检验的条件,而且要求实验室在日常工作要有文件化的工作程序。
下面就在PCR实验室建设过程中的几个关键控制点进行阐述:
根据实验室的具体情况编写质量体系文件,《质量手册》、《程序文件》、《作业指导书》,并保证管理体系运行有效。
管理体系的特点是应有明确的目的、规范的管理、有效的制约、高效的机制、能自我发展的整体。
建立完善的SOP文件,对完成各项质量活动的方法作出规定,每个SOP都应对一个或一组相互关系的活动进行描述。
每个SOP文件应说明该项质量各环节的输入、转换和输出所需的文件、物资、人员、记录以及它们与有关活动的接口关系。
明确每个环节转换过程中各项因素的要求,即由谁做、做什么、做到什么程序、达到什么要求,如何控制、形成什么记录和报告,以及相应的审批手续。
规定在质量活动中需要注意的例外或特殊情况的纠正措施。SOP应简练、明确和易懂并且工作人员熟练掌握和严格遵守。
要完成一组PCR实验,通常需要经过试剂配制、样品处理、核酸扩增和产物分析4个实验过程。
这4个实验过程的实验用房应相邻布置,组成一个独立的PCR实验区。标准的PCR实验区包括:试剂准备区、标本制备区、扩增区、产物分析区、各区配套的缓冲区及公共走廊。
某医院PCR实验室平面布局如图1所示,整个区域有一个公用走廊,每个独立实验区设有专门的缓冲区。通过压差控制,使整个PCR实验过程中试剂和标本免受气溶胶的污染,并且降低扩增产物对人员和环境的污染。
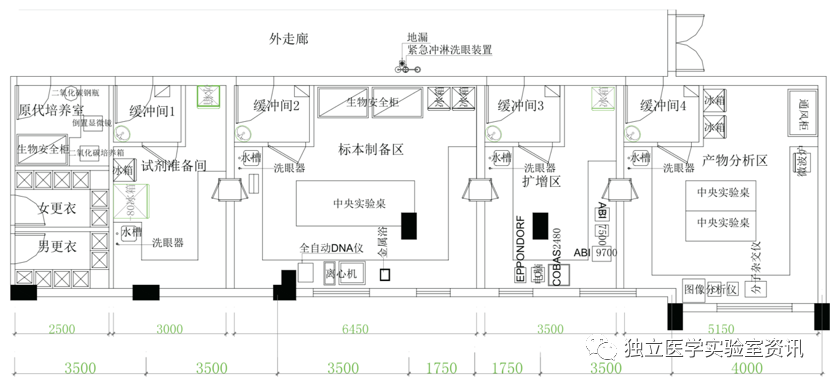
图表1、某医院PCR实验室平面图
该实验区主要进行的操作为贮存试剂的制备、试剂的分装和主反应混合液的制备。
试剂和用于标本制作的材料应直接运送至该区,不得经过其他区域。试剂原材料必须贮存在本区内,并在本区内制备成所需的贮存试剂。
试剂准备区配备有2~8°C冰箱和-80°C冰箱,计算冷负荷时,需要将它们计算在内。
房间的面积宜控制在15m²~20m²。本区的压力梯度要求为:相对正压状态,以防止外界含核酸气溶胶的空气进入,造成污染。
该区域主要进行的操作为临床标本的保存、核酸(RNA、DNA)提取、贮存及其加入至扩增反应管和测定RNA时cDNA的合成。
标本制备区配备有2~8°C冰箱和-20°C冰箱,计算冷负荷时,需要将它们计算在内。在标本制备区,还需要配备生物安全柜,用于进行提取核酸的操作。
为避免提取的核酸在柜内反复循环,造成标本之间的交叉污染,出现假阳性结果,该区域配备的生物安全柜必须是B2型的。生物安全柜工作区垂直气流全部来自实验室,排风经过高效过滤器过滤后直接排至室外,不允许回到安全柜和实验室中。
根据经验,如果实验室内配备生物安全柜,每配备一台,实验室的面积增加10m2;标本制备区的面积宜在25m²~30m²之间。本区的压力梯度要求为:相对于邻近区域为正压,以避免从邻近区进入本区的气溶胶污染。
该区域主要进行的操作为DNA或cDNA扩增。此外,已制备的DNA模板和合成的cDNA(来自样本制备区)的加入和主反应混合液(来自试剂贮存和制备区)制备成反应混合液等也可在本区内进行。
在巢式PCR测定中,通常在第一轮扩增后必须打开反应管,因此巢式扩增有较高的污染危险性,第二次加样必须在本区内进行。
扩增室主要配备PCR实验室的核心仪器PCR仪。
在实验室建造过程中,需要给PCR仪配备专门的UPS电源,以保证其正常工作。该区面积控制在15m²~20m²。
本区的压力梯度要求为:相对于邻近区域为负压,以避免气溶胶从本区漏出。为避免气溶胶所致的污染,应尽量减少在本区内的不必要的走动。个别操作如加样等应在超净台内进行。建议采用5~10Pa压差,在控制上比较容易实现。
该区域主要进行的操作为扩增片段的测定。如使用全自动封闭分析仪器检测,此区域可不设。
在室内配备通风橱,保证房间内的相对负压,空气从室外流向室内。该区面积控制在15m²~20m²。
本区是最主要的扩增产物污染来源,因此对本区的压力梯度的要求为:相对于邻近区域为负压,以避免扩增产物从本区扩散至其它区域。建议采用5~10Pa压差,在控制上比较容易实现。
根据压力梯度的要求,试剂配制室和样品处理室为相对正压,扩增室和产物分析室为相对负压,要求正压的区域和要求负压的区域的缓冲室内的压力设计大不相同。
正压缓冲室符合一般正压洁净室的缓冲原则,主要是防止室外环境空气中的气溶胶进入室内。
负压缓冲室则是要求缓冲室对核酸扩增室及产物分析区保持正压,对缓冲室外也保持正压(主要是满足室内净化需要,如室内无洁净要求,此处可以为0压)。
PCR实验室设计的核心问题是如何避免污染。在实际工作中,常见的有以下几种污染类型:扩增产物的污染;天然基因组DNA的污染;试剂的污染以及标本间的污染。因此要避免污染,首先应是预防,而不是排除。
工作区域的严格划分,各个实验区域要有明显的标记(如醒目的门牌或不同的地面颜色等),以避免各个不同实验区域设备物品、试剂等发生混淆。
合理的系统设置,合理的空调通风系统设置,尽量采用全送全排的空调系统;严格的气流压力控制,保证不同的实验区内不同的压力要求。
规范的操作,临床基因扩增检验实验室的技术人员必须进行上岗培训,在实验操作过程中,操作者必须戴手套,并经常更换。清洁工作及时、正确。实验工作结束后,必须立即对本区进行清洁。
严格的管理:严格控制进出实验室的人员。在各个实验区域使用带有明显区别标志的工作服(如不同颜色),当工作人员离开时不得将本区的工作服带至其它区域;尽量减少在实验区内不必要的走动以减少交叉污染的可能性。扩增产物分析区是最主要的扩增产物污染来源,废液不能在实验室中倾倒,必须经消毒液浸泡消毒后在远离实验室的地方弃掉,用过的吸头等一次性材料也应经消毒液浸泡消毒后统一处理,如焚烧等;
新冠病毒核酸检测的实验室要求
1.核酸检测过程包括标本处理、核酸提取,进行PCR检测等多个步骤,平均检测时间需要2-3个小时。由于它是直接对我们采集标本中的病毒核酸进行检测,特异性强,敏感度相对较高,是当前主要的检测手段。
2.《关于做好防范疫情输入相关城市新型冠状病毒检测工作的通知》联防联控机制综发〔2020〕128号文件中要求:加强实验室检测质量控制,开展检测的实验室应当使用经药监部门批准的检测试剂和采样拭子。疾控机构实验室开展PCR检测应当具备相应条件。医疗机构实验室开展PCR检测应当按照要求通过技术审核,在省级卫生健康行政部门登记备案。
疾控机构和医疗机构实验室开展新型冠状病毒检测,均应当纳入质量控制体系,开展实验室室内质控和室间质评工作,并符合实验室生物安全要求。医学检验实验室开展新冠病毒相关检测,应当符合《医学检验实验室基本标准(试行)》《医学检验实验室管理规范(试行)》等要求,保证生物安全和遗传资源管理符合相关规定。
3. 《新型冠状病毒实验室生物安全指南(第二版)》国卫办科教函﹝2020﹞70号 、《新型冠状病毒肺炎防控方案(第五版)附件<新型冠状病毒肺炎实验室检测技术指南>》国卫办疾控函〔2020〕156号均提出:根据目前掌握的新型冠状病毒的生物学特点、流行病学特征、临床资料等信息,该病原体暂按照病原微生物危害程度分类中第二类病原微生物进行管理。具体要求:感染性材料或活病毒在采用可靠的方法灭活后进行的核酸检测、抗原检测、血清学检测、生化分析等操作应当在生物安全二级实验室进行。
4. 国家卫生健康委员会办公厅《关于进一步加强新冠肺炎疫情防控期间发热门诊设置管理和医疗机构实验室检测的通知》国卫办医函〔2020〕263号中要求三级综合医院均应建立符合生物安全二级及以上标准的临床实验室,有条件的专科医院、二级综合医院也应当完善相关配备,提高冠状病毒核酸检测能力。
5.《病原微生物实验室生物安全管理条例》2018年修改:第二十五条 新建、改建或者扩建一级、二级实验室,应当向设区的市级人民政府卫生主管部门或者兽医主管部门备案。
6.《关于进一步做好疫情期间新冠病毒检测有关工作的通知》联防联控机制综发〔2020〕152号:落实实验室备案或准入要求,依法依规检测。
新冠病毒检测应当由符合条件的医疗机构(包括独立设置的医学检验实验室)和疾控机构开展。医疗机构开展病原学检测应当具备在设区的市级人民政府卫生健康主管部门备案的生物安全二级及以上实验室资质,且符合《医疗机构临床基因扩增检验实验室管理办法》(卫办医政发〔2010〕194号)的要求,具有PCR实验室条件。